CMO服务
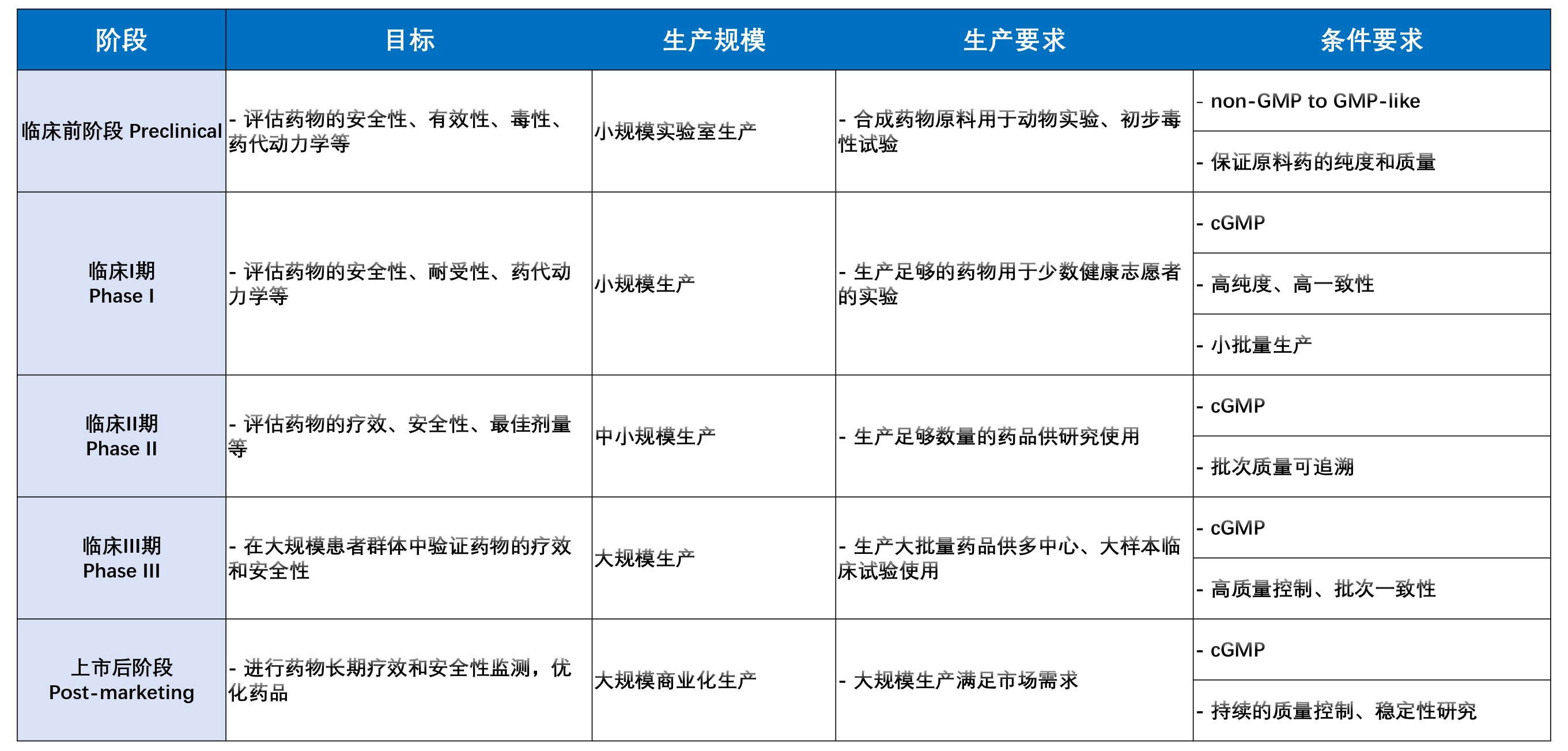
药品开发分为多个阶段,每个阶段都有不同的目标和要求,各个阶段对生产的需求也不同。这些需求与条件紧密相关,保证了药品的安全性、有效性、质量稳定性及合规性。以下是药品开发过程中前期主要阶段(主要侧重在临床前阶段、临床I期、临床II期)的生产需求和条件。
一、临床前阶段(Preclinical Stage)
在临床前阶段,药品开发主要集中在药物的初步筛选、药理学研究、毒理学研究以及动物实验。这一阶段的生产需求相对较低,主要是提供足够的物料支持毒理学和药效学实验,并为临床试验做准备。生产的重点是确保药物的纯度、稳定性以及可扩展性。
小规模生产:生产的规模通常较小,只需满足实验室研究、动物实验和初步的药效评估。此阶段的重点是药物的初步验证,而非大规模生产。
质量控制:虽然生产规模较小,但需要确保药品的质量和纯度,特别是药物成分的稳定性、溶解性和生物可利用性。
GMP基础要求:虽然临床前阶段的生产对GMP的要求较为宽松,但仍需遵循基本的生产规范,确保产品无污染、无杂质。
二、临床I期(Phase I)
临床I期试验的主要目的是评估药物的安全性、剂量耐受性及初步的药代动力学特征。这一阶段的生产需求相较于临床前阶段有所增加,需要足够的药物材料以支持志愿者的剂量递增实验。
小批量生产:尽管进入临床阶段,但生产量通常还是维持在小规模,目标是为初步的临床试验提供支持。
符合GMP要求:进入临床试验阶段,药品生产必须符合GMP标准。GMP确保药物的一致性、无菌性和稳定性。
纯度与安全性:药品的纯度和质量要求更加严格,因为药品将直接用于人体试验。生产过程中的每一个环节都要进行详细记录,以确保每个批次产品符合预定质量标准。
三、临床II期(Phase II)
临床II期试验的主要目的是进一步评估药物的疗效及其在特定患者群体中的安全性。在这一阶段,药物的生产需求进一步增大,必须满足更大规模临床试验的需要。
中等规模生产:进入临床II期后,生产量会增加,以支持更多患者的试验需求。此时的生产规模相比I期更大,但仍处于相对小批量的范畴。
标准化生产工艺:生产工艺需要进一步优化和标准化,确保每批药品在质量上的一致性,且符合GMP的要求。
稳定性与长期储存:药品的稳定性要求更高,特别是对于需要长期储存的药物,需要确保产品在保存过程中保持有效性与安全性。此外,生产过程中的温度控制和运输条件也变得更加严格。

佰炼医药拥有坚实的硬件条件和雄厚的技术实力,满足各种客户在不同阶段的生产需求
GMP生产车间:
占地面积1500m2,符合cGMP和病原微生物BSL-2实验室要求。实验室建有符合IIT临床研究、IND申报的多条A级生产线,可以为新型细胞与基因治疗药物研发企业提供委托开发和生产服务。
GMP级生产线:
基因修饰的自体细胞生产工艺车间(隔离器+蜂巢培养箱)
通用型细胞生产工艺车间(无菌密闭管路)
病毒载体贴壁与无血清悬浮生产工艺车间
病毒载体隔离器A级手动/半自动灌装生产线



