VLP递送系统介绍
类病毒颗粒(VLPs)是由病毒的单一或多个结构蛋白自行装配而成的高度结构化的蛋白颗粒,在形态结构上与天然的病毒颗粒相似,具有很强的免疫原性和生物学活性。与传统减毒疫苗相比,VLPs缺乏调节蛋白和感染性核酸,无复制能力,结构上与病毒颗粒类似,保留强免疫原性。
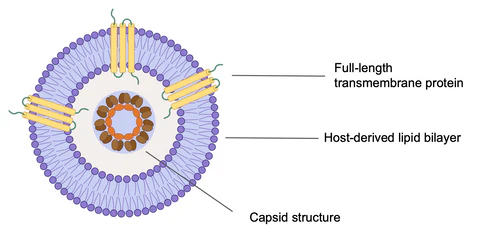
图1. VLP类病毒颗粒结构
VLP的应用
VLP应用于疫苗开发
由于VLP病毒样外观和多聚抗原的表面结构,进入机体可引发免疫反应,并诱导机体产生高滴度抗体, 因此VLP常用于疫苗的开发。以VLP为基础的预防性疫苗有很多,例如葛兰素史克的Engerix®(HBV)和Cervarix®(HPV),默克公司的Recombivax HB®(HBV)和Gardasil®(HPV)。其他一些常见的病毒结构蛋白,如人类免疫缺陷病毒(HIV)、腺相关病毒(AAV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和噬菌体,也已被应用于VLP的制备和生产。
VLP作为递送系统
VLP易感染进入细胞,可以在宿主细胞中自组装,产生大分子复合物并释放到细胞介质,常用作递送载体,将DNA、RNA、siRNA、特异性抗体、配体和药物小分子等递送至靶细胞。例如,基于慢病毒开发的VLP介导的CRISPR/Cas9递送,实现了高效安全的基因编辑,极大地扩展了核酸治疗的应用。例如,通过改造的病毒样颗粒(engineered virus-like particle, eVLP)在体内高效递送基因编辑蛋白基因到宿主细胞中的研究,展示了VLPs在基因治疗领域的潜力。
应用VLP递送mRNA的研究主要有张锋、刘如谦David Liu和蔡宇伽团队。
张锋团队的SEND(Selective Endogenous eNcapsidation for cellular Delivery)系统
三质粒系统递送基因:共转染Peg10质粒(慢病毒Gag同源物)、cargo-RNA-UTR质粒和包膜质粒,利用Peg10蛋白可结合Peg10 UTR的原理,形成包含外源基因mRNA的VLP,包膜蛋白赋予VLP感染各类细胞的能力。
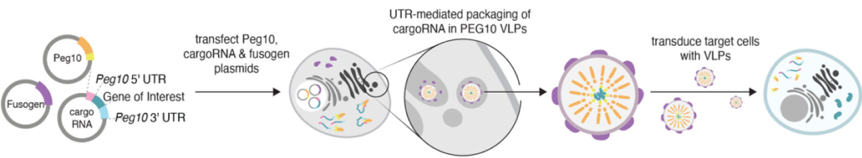
图2 SEND三质粒系统递送基因
四质粒系统递送Crispr-Cas9基因编辑工具:共转染Peg10质粒、SpCas9-RNA-UTR质粒、U6-sgRNA质粒和包膜质粒,利用Peg10蛋白可结合Peg10 UTR的原理,SpCas9可结合sgRNA的原理,形成包含SpCas9 mRNA-sgRNA的VLP,包膜蛋白赋予VLP感染各类细胞的能力。体外细胞水平Indel效率可达40%。
刘如谦团队的VLP递送系统
V4-BE-eVLP系统(2022年):递送碱基编辑器(BEs),共转染MLVgag-pol质粒、MLVgag-linker-BE质粒、sgRNA和包膜质粒,利用Gag蛋白和BE共表达原理和sgRNA和BE结合原理,形成包含BE蛋白-sgRNA的VLP,包膜蛋白赋予VLP感染各类细胞的能力。体外细胞编辑效率可达90%,体内小鼠编辑效率可达63%。
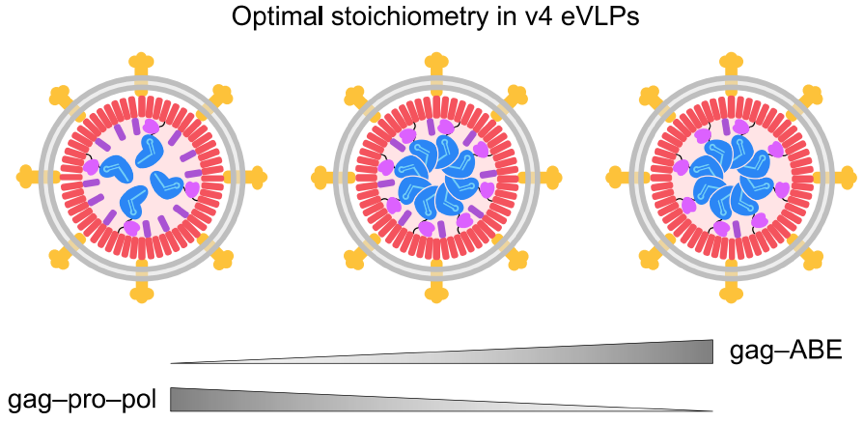
图3 携带BEs-gRNA的VLP
V3b-PE-eVLP系统(2024年):递送先导编辑器(PEs),共转染MLVgag-pol质粒、P4-PE质粒、Gag-COM-Pol质粒、Gag-P3-Pol质粒COM-gRNA质粒和包膜质粒,利用P3蛋白和P4结合原理和COM和COM-gRNA结合原理,形成包含PE蛋白-gRNA的VLP,包膜蛋白赋予VLP感染各类细胞的能力。此系统递送效率优于V3-PE-eVLP系统
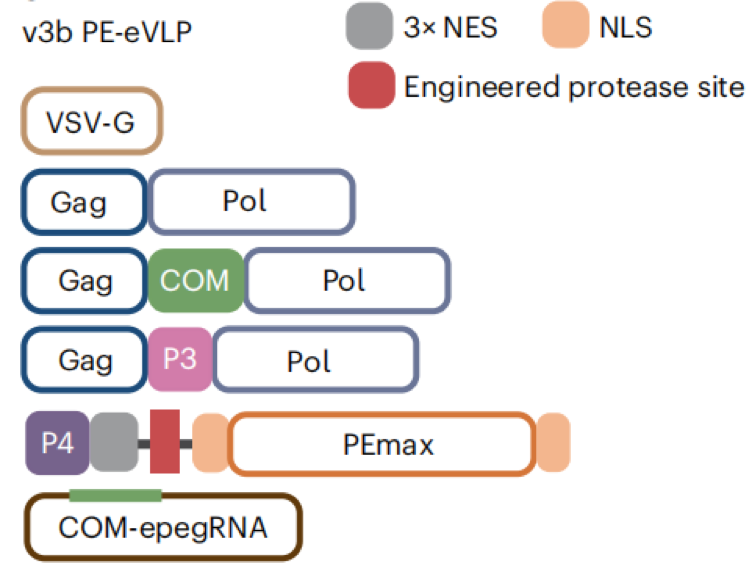
图4 V3b-PE-eVLP系统
蔡宇伽团队的VLP递送系统mLP-CRISPR
六质粒系统递送Crispr-Cas9基因编辑工具:基于慢病毒质粒系统,共转染Gag-pol-D64V质粒、MS2M-Gagpol-D64V质粒、pLV-egfp-sgRNA质粒、Cas9-6×MS2质粒、pRev质粒和包膜质粒,利用MS2M和MS2结合的原理,慢病毒gag蛋白结合pLV-egfp-sgRNA上包装信号的原理,形成包含SpCas9 mRNA-sgRNA的VLP,包膜蛋白赋予VLP感染各类细胞的能力。
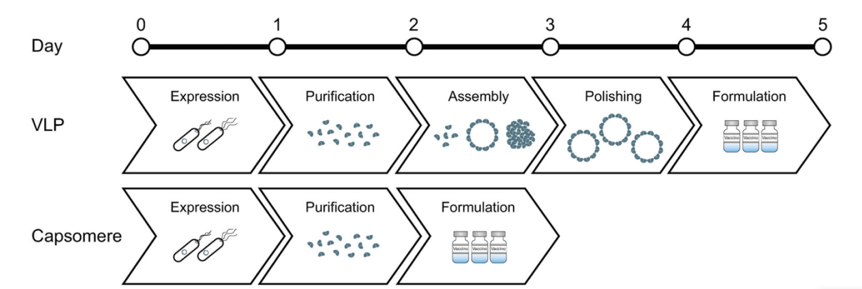
图5. VLPs制备流程(Lua LH et al., Biotechnology and bioengineering, 2014)
主流基因治疗递送系统的比较

总结:
病毒载体(AAV、慢病毒):适合长期表达,但存在容量限制(AAV)或整合风险(慢病毒)。
非病毒载体(LNP、GalNAc):LNP灵活但靶向局限,GalNAc肝靶向高效但应用单一。
生物源性载体(外泌体、VLP):外泌体低免疫原性,VLP结合瞬时与大容量优势,但均需进一步优化生产工艺。