外泌体递送系统介绍
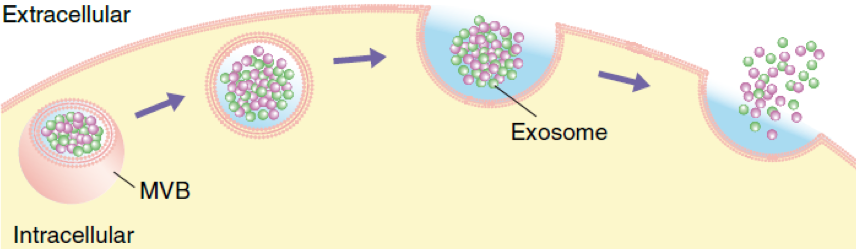
外泌体(exosome)是通过多泡体(MVB)与质膜融合并分泌直径为30-150nm的细胞外囊泡(extracellular vesicles, EVs),EVs具有良好的生物相容性,可运输多种分子,如蛋白质、脂质和核酸,包括信使RNA、非编码RNA和DNA,且能保护其在体内被降解,这些优势使EVs成为理想的药物递送载体。此外,通过在细胞之间交换功能内容,外泌体在维持体内平衡和对抗压力方面发挥着重要作用。另外外泌体还参与多种促肿瘤活动,包括抗细胞凋亡、转移、血管生成、免疫逃避和化学抵抗。因为发现EVs的运输调控机制,三位科学家获得了2013年的诺贝尔生理或医学奖,是过去十多年最受关注的新兴研究领域。
从结构上看,外泌体具有单层膜的结构,其水性核心周围被脂质双分子层所环绕。当外泌体被用作药物递送系统时,疏水性药物可分散在其脂质双分子层内,而亲水性药物则扩散到外泌体的腔内。从载药机制的角度来看,由于外泌体药物递送系统的结构与脂质体相似,因此可将其视为与脂质体性质相当的药物载体。同时,基于其穿透能力强,甚至能突破血脑屏障,且血液循环时间长。
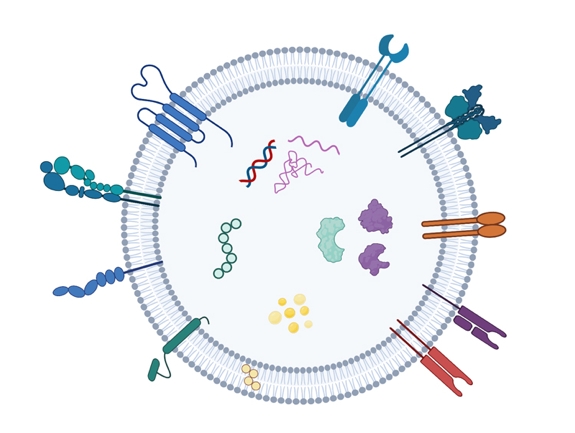
外泌体在大小和功能上与合成的纳米颗粒类似,但作为天然内源性转运载体,具有毒性低、无免疫原性、渗透性好等优势。值得一提的是,与病毒载体和脂质纳米颗粒等其他递送方法相比,外泌体的一个关键优势是可以精确地递送有效载荷,而不激活先天或后天免疫系统。这使得重复给药更加容易,因为患者在第一次治疗后不会获得对运载工具的免疫力,该问题也是近年来基因治疗遇到的主要障碍。
外泌体的工程化改造可以赋予外泌体新特性:首先,将配体或靶向肽与外泌体表面表达的跨膜蛋白基因融合;然后用编码融合蛋白的质粒通过各种方式去转染工程化细胞,工程化细胞分泌在其表面带有靶向配体的工程外泌体。
工程化外泌体系统包含一个促进外泌体分泌、特异性蛋白质/RNA包装、以及靶向运送的装置,可在改造的哺乳动物细胞中高效生产定制化的外泌体。
- 在递送编码蛋白时(蛋白替代),系统内含有3个质粒:
- 载有目的蛋白质包装装置(CD63+目的蛋白);
- 载有特殊靶向功能的模块(如RVG-Lamp2b靶向到脑部) 作为靶向递送装置;
- 载有STEAP、syndevan-4和NadB组成的外泌体生产促进器(Production booster)。
在递送RNA系统时,将蛋白质包装装置替换为RNA包装装置:CD63+L7Ae(L7Ae能够结合RNA连接的C/D BOX)质粒与目的mRNA/shRNA+C/DBOX质粒
工程化外泌体递送应用方向
- 递送mRNA,以及环状circRNA等。其中,mRNA编码的蛋白可以用于蛋白替代,如编码各种酶、RNA结合蛋白等;mRNA编码的蛋白也可以表达在外泌体膜表面,表达抗体片段、CAR、靶向肽、荧光蛋白等,从而实现靶向性。
- 递送小核酸,包括ASO, siRNA, miRNA等。实现RNAi药物等的体内递送。
- 递送基因编辑器,如CRISPR系统,碱基编辑器等。实现体内体外的基因编辑(以及药物)递送。
- 递送小分子,用电穿孔技术将目的小分子装载至外泌体中,包括水溶性、脂溶性等小分子,实现药物递送。